Teori atom Dalton yang dikembangkan pada awal tahun 1800 menjadi dasr perkembangan ilmu kimia, terutama dalam menjelaskan reaksi-reaksi kimia. perkembangan teori atom Dalton tidak terlepas dari penyelidikan para ahli kimia pada akhir abad ke-17. Mereka menyelidiki hubungan antara jumlah zat hasil reaksi dan jumlah pereaksi. Penyelidikan yang mereka lakukan melahirkan hukum-hukum dasar kimia. Bagaimana isi dan manfaat dari hukum-hukum dasar kimia tersebut?
1. Hukum Kekekalan Massa
Hukum kekekalan massa diperkenalkan oleh ilmuan kimia Prancis, Antoine Laurent Lavoisier pada 1787. Saat itu, para ilmuan memercayai bahwa reaksi pembakaran menghasilokan gas flogiston sehingga massa zat setelah pembakaran lebih sedikit daripada sebelumnya. Hal tersebut didasarkan pada percobaan yang dilakukan Pristley. Pristley memanaskan oksida raksa (red calx mercury). Reaksi pemanasan padatan oksida raksa menghasilkan air raksa dan gas tidak berwarna di atasnya. Setelah ditimbang, massa air raksa lebih sedikit daripada massa oksida raksa.
Pristley menyebut gas tidak berwarna itu dengan istilah flogiston. Namun, tidak demikian dengan Lavoisier, ia meragukan adanya gas flogiston. Menurut dugaannya, yang dimaksud flogiston adalah gas oksigen. kemudian Lavoisier mengulang percobaan Pristley untuk membuktikan dugaannya. Ia menimbang massa zat sebelum dan setelah reaksi pemanasan oksida raksa secara teliti menggunakan timbangan yang peka. Ternyata terjadi pengurangan massa oksida raksa.
Lavoisiser menjelaskan alasan berkurangnya massa oksida raksa setelah pemanasan. Ketika dipanaskan, oksida raksa menghasilkan gas oksigen sehingga massanya berkurang. Lavoisiser juga membuktikan kebalikannya. Jika sebuah logam dipanaskan di udara, massanya akan bertambah sesuai dengan jumlah oksigen yang diambil dari udara. Kesimpulan Lavoisier tersebut dikenal dengan nama hukum kekekalan massa.
Dengan penemuan Lavoisiser, teori flogiston yang dipercayai para ilmuan kimia selama kurang lebih 100 tahun akhirnya tumbang. Lavoisiser juga menyatakan proses berkeringat merupakan hasil pembakaran lambat di dalam tubuh. Pada saat beraktivitas, makanan di dalam tubuh akan terbakar (bereaksi) menghasilkan air (berupa keringat) dan gas CO2.
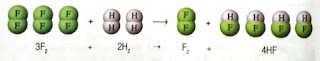
Hukum kekekalan massa juga menginspirasi Dalton ketika mengemukakan teori atom. Salah satu isi teori atom Dalton menyatakan bahwa atom berbentuk bola sederhana yang sangat kecil, tidak dapat dibelah, diciptakan, ataupun dimusnahkan. Bukan hanya itu, hukum kekekalan massa juga memberikan jawaban dari pertanyaan, "Mengapa persamaan reaksi harus disetarakan?". Perhatikan contoh persamaan reaksi berikut.
Beberapa Contoh Soal dan Pembahasan tentang Hukum Kekekalan Massa dapat dilihat sebagai berikut:
Contoh Soal 1:
Sebanyak 32 gram serbuk sulfur direaksikan dengan gas oksigen menghasilkan gas sulfur dioksida sebanyak 64 gram. Berapa massa gas oksigen yang bereaksi?
Contoh Soal 2:
Sebanyak 1 gram logam magnesium direaksikan dengan gas klorin menghasilkan magnesium klorida sebanyak 4 gram. Berapakah massa gas klorin yang bereaksi?
Penyelesaian:
logam Magnesium dan gas klorin dalam hal ini berfungsi sebagai reaktan (pereaksi), sementara Magnesium klorida adalah hasil reaksi (produk). Sesuai konsep hukum kekekalan massa, jumlah zat pereaksi harus sama dengan jumlah hasil reaksi, Reaksi tersebut dapat ditulis dalam bentuk persamaan sebagai berikut:
Mg + Cl2 ---> MgCl2
1 + ........ = 4
sehingga massa gas klorin yang dibutuhkan untuk menghasilkan 4 gram MgCl2 adalah 3 gram.
Contoh Soal 3:
Sebanyak 254 gram tembaga dan 128 gram belerang (sulfur) bereaksi habis membentuk senyawa tembaga sulfida. Menurut Hukum Kekekalan Massa,berapa banyak tembaga sulfida yang akan diperoleh dari reaksi tersebut ?
Penyelesaian
Menurut Hukum Kekekalan Massa,
Massa zat-zat sebelum reaksi = massa zat-zat sesudah reaksi
Massa Cu+ massa belerang = Massa tembaga sulfide
Reaksi: Cu + S ----> CuS
254 + 128 = massa CuS
Jadi, massa tembaga sulfida = 382 gram
Contoh Soal 4
Data percobaan reaksi tembaga dengan sulfur membentuk tembaga (II) sulfida sebagai berikut:
| No. Percobaan | Massa Tembaga (gram) | Massa Sulfur (gram) | Massa Tembaga (II) Sulfida (gram) |
| 1 2 3 4 | 10 14 10 8 | 4 3 5 5 | 6 9 15 12 |
Berdasarkan data tersebut, perbandingan massa tembaga dan massa sulfur dalam tembaga (II) sulfida adalah ….
A. 1 : 1
B. 1 : 2
C. 2 : 1
D. 2 : 3
E. 3 : 2
Penyelesaian;
Menurut Hukum Kekekalan Massa yang disampaikan oleh Antoine Lavoisier, massa zat sebelum dan sesudah reaksi adalah sama. Berpedoman pada hukum tersebut, percobaan pada tabel di atas yang memenuhi hanyalah percobaan nomor 3.
massa tembaga + massa sulfur = massa tembaga (II) sulfida
10 gram + 5 gram = 15 gram
Percobaan yang lain merupakan reaksi berlebih, artinya akan terdapat sisa pereaksi pada akhir reaksi.
Sedangkan menurut Hukum Perbandingan Tetap (hukum Proust), perbandingan massa unsur dalam suatu senyawa adalah tetap. Sehingga perbandingan massa tembaga dan sulfur dalam senyawa tersebut adalah:
massa tembaga : massa sulfur = 10 : 5
= 2 : 1
Jadi, perbandingan massa tembaga dan massa sulfur dalam tembaga (II) sulfida adalah 2 : 1 (C).
Contoh Soal 5:
Sebanyak 5,4 gram logam aluminium habis bereaksi dengan 4,8 gram oksigen dalam ruang tertutup membentuk aluminium oksida menurut persamaan reaksi:
4Al (s) + 3O2 (g) → 2Al2O3 (s)
Massa aluminium oksida yang dapat terbentuk sebanyak …. (Ar Al = 27, O = 16)
A. 4,8 gram
B. 5,4 gram
C. 9,6 gram
D. 10,2 gram
E. 10,8 gram
Penyelesaian
Karena disebutkan 'habis bereaksi' maka reaksi tersebut telah memenuhi hukum kekekalan massa (hukum Lavoisier). Reaksi tersebut tepat bereaksi, tidak ada sisa sedikit pun sehingga massa aluminium oksida yang dihasilkan merupakan penjumlahan langsung dari pereaksinya.massa Al2O3 = massa Al + massa O2
= 5,4 gram +4,8 gram
= 10,2 gram
Jadi, massa aluminium oksida yang terbentuk adalah 10,2 gram (D).


No comments:
Post a Comment